[프레그런스저널코리아 손현주 기자] 식품의약품안전처 식품의약품안전평가원이 ‘2016년 분야별 허가 심사 가이드라인 및 해설서 발간 계획’을 수립했다고 밝혔다.
이번 발간 계획은 의약품과 바이오의약품, 의약외품, 화장품, 한약(생약)제제의 개발을 지원하고 허가, 심사의 예측성과 투명성을 높이기 위해 마련됐다. 또 정부 3.0 투명한 정부, 서비스 정부 정책의 일환으로 관련 업계가 제품 개발에 필요로 하는 허가·심사 정보를 주요 내용으로 한다.
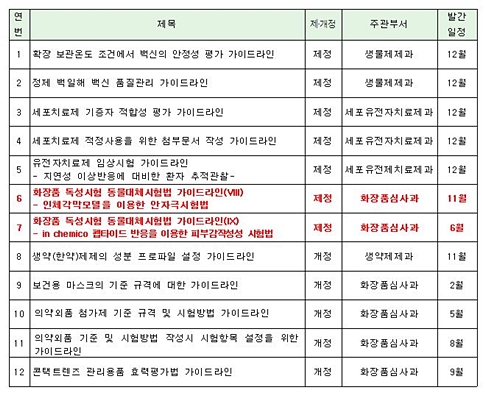
발간 계획에 따르면 화장품심사과는 올해 화장품 관련 2건, 의약외품 관련 4건의 가이드라인을 새로 제정할 예정이다.
화장품심사과는 오는 6월 ‘화장품 독성시험 동물대체시험법 가이드라인(IX)- in chemico 펩타이드 반응을 이용한 피부감작성성 시험법’을, 11월에는 ‘화장품 독성시험 동물대체시험법 가이드라인(VIII)- 인체각막모델을 이용한 안자극시험법’에 대한 가이드라인을 새롭게 만들 예정이다.
이밖에 ▲보건용 마스크의 기준 규격에 대한 가이드라인 ▲의약외품 첨가제 기준 규격 및 시험방법 가이드라인 ▲의약외품 기준 및 시험방법 작성시 시험항목 설정을 위한 가이드라인 ▲콘택트렌즈 관리용품 효력평가법 가이드라인 등 총 4건의 의약외품 관련 가이드라인을 새로 제정할 계획이다.
식약처 2016년 가이드라인 제개정 계획 목록
 |
Copyright ⓒ Since 2012 COS'IN. All Right Reserved.