# 피부장벽 개선과 피부노화 방지 효능 사과캘러스 유래 엑소좀 'Phytotherasome™ Apple'
1. 서론
피부는 인체의 최외각을 감싸는 중요한 보호 기관중 하나로 외부 물질로부터 인체를 보호해 주는 중요한 역할을 한다. 최근에는 자외선, 미세먼지 등 외부 물질에 대한 피부 손상을 개선하고자 하는 연구가 지속되고 있다. 자외선이 피부에 노출이 되면 protein kinase R(PKR) 활성화를 통해 광손상과 관련된 단백질 인자들의 생성을 촉진하면서 피부 노화가 발생 된다1).
따라서 자외선에 대한 과도한 피부의 노출은 피부암 등 피부질환에 직접적인 영향을 끼칠 수 있다2). 또 외부 환경으로부터 피부장벽이 무너지게 되면 아토피와 건선 등 피부 염증이 유발된다3). 이에 피부 개선을 위한 소재에 관심이 꾸준하게 증가하고 있다. 특히 천연물 소재에서 피부장벽 보호와 피부 노화 방지를 위한 연구가 지속되고 있다.
상업적으로 사용하기 위한 천연물의 수요가 증가되고 있지만 식물은 지속 불가능한 자원이기 때문에 안정적인 수확이 필요한 실정이다. 이에 따라 식물 조직 배양은 지역, 온도 등 외부 환경에 구애받지 않으며 안정적으로 지속적인 생산이 가능하기 때문에 산업규모에서 이용가치가 높은 기술이다4). 이러한 이점으로 대량 증식과 형질전환식물체 개발 등에 이용해 화장품, 건강기능식품, 의약품 분야에서 연구가 활발히 이루어지고 있다.
본 연구에서는 식물 조직 배양을 통해 얻은 캘러스에서 분리된 exosome-like nanovesicles 효과에 관한 연구를 진행했다. Exosome-like nanovesicles은 다양한 생물학적 활성을 포함해 표적 세포와 상호작용하면서 생리적 기능과 병리적 기능을 수행한다5). 최근 연구에 따르면, 식물에서 분리된 exosome-like nanovesicles(PELNs)와 동물에서 분리된 엑소좀과 유사한 구조를 갖고 있으며 세포 간 통신을 통해 mRNA, miRNA, 유전 정보를 전달하는 메신저 역할을 한다는 사실이 보고 됐다6). 이러한 PELNs은 항염 효과, 항암 효과, 지방간 감소 효과가 있는 것으로 보고됐다7).
이 뿐 아니라 PELNs은 흑색 종 세포에서 멜라닌 생산을 억제해 미백효과가 있어 천연 화장품으로도 우수한 소재이다8). 하지만 식물 조직배양 기술을 이용해 캘러스를 유도하고 이에 따른 exosome-like nanovesicles의 피부 개선 효능에 대한 연구는 미미한 실정이다.
본 연구의 재료인 사과(Malus domestica)는 식이섬유, vitamin C, phenolics 등 다양한 생물학적 활성물질이 풍부하다9). 사과의 유용성분들은 항염증, 항균, 항암, 심혈 관계 개선 등 생물학적 특성과 관련되어 있다10). 이러한 사과의 우수한 효능에도 불구하고 사과 열매 유래 캘러스에서 exosome-like nanovesicles를 분리하고 이에 대한 효능 연구는 보고되지 않았다.
이에 본 연구에서는 사과 열매로부터 유도된 캘러스를 이용해 nanovesicles를 분리했다. 분리된 exosomelike nanovesicles(ACELNs)은 나노 입자크기와 개수를 측정해 nanovesicles의 정량적 분석을 진행했다. ACELNs의 세포 독성 실험을 분석하고 각질세포 외막(cornified envelope, CE) 평가를 통해 피부장벽 효과를 검증했다.
또 quantitative real-time polymerase chain reaction(qRT-PCR)을 통해 collagen type 1(COL1A1) 와 fibrillin(FBN1)유전자 발현에 대한 영향을 분석하고 ELISA 분석을 통해 collagen 생성에 대한 분석했다. 따라서 본 연구과제를 통해 ACELNs가 피부장벽과 피부 노화 개선에 미치는 영향으로 천연 화장품 소재로서의 활용가능성을 시사했다.
2. 실험방법
2-1. 실험재료
실험에 사용한 사과 열매(Malus domestica)는 능금농협(Korea)에서 분양받아 사용했다. 사과 열매는 흐르는 물에 세척한 후 70% 에탄올에서 1min 동안 1차 살균했다. 1% sodium hypochlorite에서 10min 동안 2차 살균 후 멸균 증류수로 3회 반복 세척했다.
살균된 열매 조직을 0.5cm2 크기로 자른 뒤 4.5mg/L NAA(α-Naphthaleneacetic Acid, NAA) (Duchefa, Netherlands)와 2.5mg/L BA (6-benzylaminopurine, BA) (Duchefa, Netherlands)가 포함된 MS(Murashige and Skoog Basal Salt Mixture, MS) (Duchefa, Netherlands) 배지에서 배양했다. 배지의 pH는 5.8으로 조정했으며 외부 온도를 27 ± 3℃로 조정해 암실에서 배양했다. 그 후 동일한 배지 조성의 50mL를 함유한 삼각 플라스크에 유도된 사과 캘러스 4g을 접종 했고 알루미늄 호일로 밀봉한 후 교반기(J-MBB2, JISICO, Korea)에서 90rpm 속도로 배양했다. 총 3∼4 주간 배양을 진행했다.
2-2. 사과 캘러스 유래 Exosome-like Nanovesicles 분리와 나노 입자 분석
배양액을 포함한 사과 캘러스 혼합액에서 Exosomelike Nanovesicles를 분리하기 위해 물리적 힘만 이용해 세포벽 파쇄를 수행했다. 그 후 세포 잔해를 제거했으며 한외여과 장치를 이용해 ACELNs를 정제, 농축했다. 최종적으로 농축된 ACELNs는 불순물을 제거하기 위해 0.2μm 제균 필터로 제균 여과했다. 최종 분리된 ACELNs는 200배 희석해 NTA(Nanosight, NS300, Malvern, Nederland)를 이용해 크기와 농도를 정량화 하기 위해 나노 입자 분석을 수행했다.
2-3. 세포 증식과 독성 평가
ACELNs에 대한 세포 증식과 독성을 확인하기 위해 CCK-8 kit(SC893, Dojindo, Japan)와 lactate dehydrogenase assay (LDH assay, PN575, Dojindo, Japan)의 제조업체 프로토콜에 따라 수행했다. 본실험에는 각질형성세포주(human kerationocyte HaCaT cell line, HaCaT)와 피부 섬유아세포(human dermal fibroblast, HDF)를 각각 10% 소태아 혈청(fetal bovine serum, FBS-22A, Capricorn, Germany)이 포함된 Dulbecco’s modified Eagle’s medium(DMEM, WELGENE, Korea)와 growth supplement kit(LSGS Kit, S-003-K, GIBCO, USA)가 함유된 medium 106(M-106-500, GIBCO, USA) 배지에서 배양했다. 본 실험에 사용된 HaCaT cells과 HDF cells은 한림대학교 생명과학과 분자면역학연구실(Korea)에서 분양받아 사용했다.
세포 증식과 독성 실험을 하기 위해 HaCaT cells 과 HDF cells을 96 well plate에 각각 5×104 cells/ mL과 1×105 cells/mL씩 분주하고 37℃, 5% CO2 incubator에서 24h 동안 배양했다. 시료를 농도 별로 처리한 후 48h 동안 배양했다. 그 후 세포 배양 상층액을 일부 취해 LDH assay를 사용해 반응시키고 spectrophotometer (Synergy HTX Multi Mode Reader, BioTek Instruments, Inc., USA)를 이용해 490nm에서 흡광도를 측정했다.
시료 처리군의 세포증식율은 시료를 처리하지 않은 음성대조군에 대한 세포증식율을 백분율로 나타냈다. 나머지 plate에 CCK-8 kit를 사용해 반응시키고 450nm에서 흡광도를 측정했다. 세포 독성은 세포막의 손상으로 인해 발생되는 LDH의 양을 측정하는 분석으로 lysis buffer을 처리한 음성대조군에 대한 시료 처리군의 세포 독성을 백분율로 나타냈다.
2-4. 각질세포 외막 평가
각질 분화 유도능을 측정하기 위해 각질세포 외막(cornified envelope, CE) 평가를 수행했다. HaCaT cells 을 6 well plate에 1.5×105cells/mL로 분주하고 37℃, 5% CO2 incubator에서 24h 동안 배양했다. 세포가 100% confluence 상태가 되면 배지에 시료를 처리하고 6일 간 배양했다. 이 때, ACELNs는 3일마다 재처리 했다. 6일 후 DPBS(PBS-1A, Capricorn, Germany)로 세척한 후 2% SDS solution을 150 µL/well 처리했다. 5min 동안 ice에서 반응시킨 후 세포들을 scraper로 수득해 5s 동안 sonication했다.
일부를 취해 BCA protein assay kit(21071, iNtRON biotechnology, Korea)를 이용해 단백질 정량했고 평가시 기준으로 잡는데 이용 했다. 나머지는 원심분리를 13,000rpm에서 20min 동안 분리한 pellet에 20mM DTT in 2% SDS solution을 100µL씩 각각 첨가했다. 90℃에서 20min 동안 끓였다. 96 well plate에 옮긴 후 spectrophotometer를 이용해 310nm에서 흡광도를 측정했다.
2-5. uantitative Real-time Polymerase Chain Reaction (qRT-PCR)
피부 노화에 중요한 영향을 미치는 세포 외 기질의 구성 인자인 COL1A1와 FBN1 유전자 발현정도를 평가하고자 했다. 동일한 농도의 HDF cells를 24 well plate에 분주하고 24h 배양했다. 그 후 ACELNs 를 처리하고 48h 동안 배양했다. 상등액을 제거하고 TaKaRa MiniBEST Universal RNA extraction kit(9767, TaKaRa, Japan)를 이용해 제조업체 프로토콜에 따라 RNA를 분리했다.
분리한 RNA의 순도를 위해 A260/280ratio를 측정했으며 260nm 측정값을 통해 RNA를 정량했다. cDNA 합성을 위해 정량한 RNA와 amfiRivert cDNA Synthesis Platinum Master Mix(R5600-200, GenDEPOT, USA)를 섞어 사용한다. 60℃에서 1min 동안 RNA denaturation, 25℃에서 5min 동안 annealing, 42℃에서 60min 동안 extend, 85℃에서 1min 동안 reverse transcriptase inactivation시켰다.
합성된 cDNA를 증폭하기위해 cDNA, primer 그리고 LightCycler ® 480 SYBR Green I Master Mix(04887352001, Roche, Swiss)를 혼합했고 LightCycler® 480 System을 이용해 quantitative PCR(qPCR)을 진행했다. 사용한 유전자의 primer의 서열은 표1과 같다.
표1 Forward and Reverse Primer PCR Sequence for qRT-PCR
2-6. Enzyme Linked Immunosorbent assay (ELISA)
ACELNs에 대한 collagen의 단백질 생성량을 분석 하기 위해 COLIA1 kit (DY6220-05, R&D Systems, Inc., USA)의 제조업체 프로토콜에 따라 평가했다. HDF cells을 96 well plate에 1×105 cells/mL씩 분주했다. ACELNs를 처리한 뒤 48h 동안 추가 배양을 진행했다. 그 후 배양 상층액을 제거하고 PBS로 채우고 나서 UVA 조사기를 사용해 5J/cm 2세기로 조사했다. UVA조사 직후에 PBS를 FBS를 포함하는 배지로 교체했고 24h 후에 배양 상층액을 일부 취했다. 배양 상층액은 collagen 생성량을 측정하는데 이용했다.
2-7. 통계처리
모든 실험 분석 값은 3회 반복실험을 통해 평균값과 표준 편차(mean ± SD)로 나타냈다. 통계적으로 유의한 차이는 95% 신뢰구간에서 student’s t-test 방법으로 검정했다.
3. 결과 및 고찰
3-1. 사과 캘러스 유래 Exosome-like Nanovesicles (ACELNs) 분리
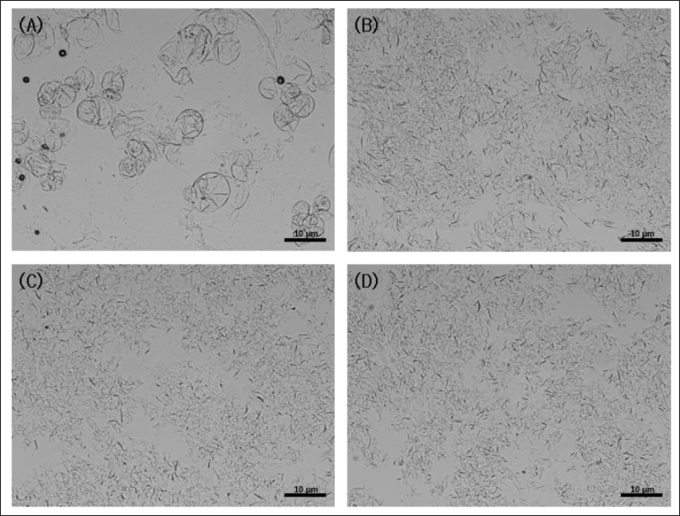
사과 캘러스와 배양액 혼합액에서 exosome-like nanovesicles를 얻기 위해 물리적 힘을 이용해 세포벽 붕괴를 했으며(그림1) 또 나노입자 크기만을 순수 분리하기 위해 한외여과 장치를 이용해 ACELNS를 정제, 농축했다. 이는 일반적인 밀도기울기를 이용한 원심분리 방법에 비해 신속하고 용이하게 사용될 수 있다11).
그림1 Microscope images of cell lysis by microfluidizer : (A) for 0 cycle, (B) 1 cycle,
(C) 2 cycles, and (D) 3 cycles at 1,000 bar.
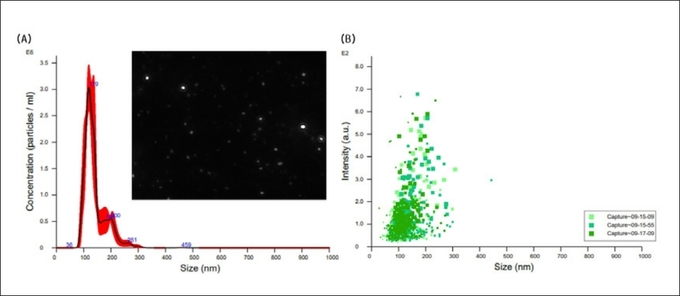
분리 정제된 ACELNs의 수율은 6.42×109 particles/mL이였으며 직경은 100∼200nm 범위로 감지됐으며 소포 크기는 다양했다(그림2). 대부분의 ACELNs의 평균 직경은 139.4nm 이며 mode 값은 118.8nm 이였다. 일반적으로 대부분의 PELNs는 50∼300nm 범위의 직경을 갖고 있는 것으로 알려져 있다12).
그림2 Nanoparticle tracking analysis of nanovesicles isolated from Malus pumila Mill . (apple) fruit callus. (A) Representative graph shows particle concentration and their size measurements. (B) The scattering distributions are presented from three consecutive 30 s runs for nanoparticles.
3-2. 피부 유래 세포 증식과 독성 억제 효과
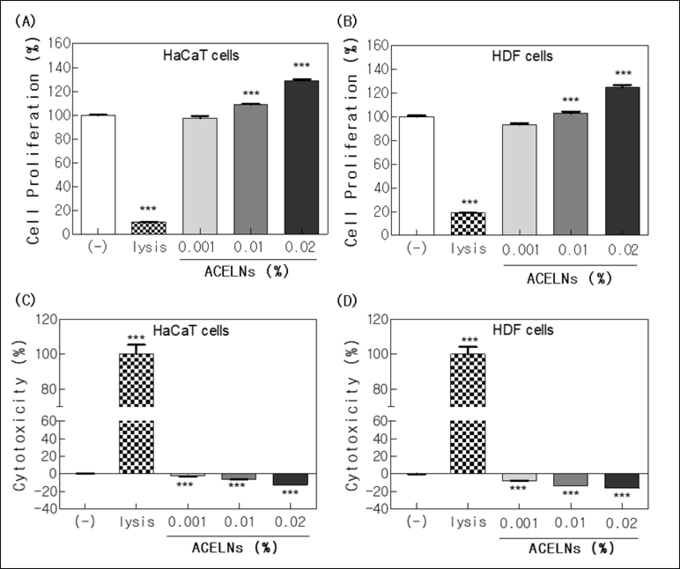
피부 유래 세포인 HDF cells과 HaCaT cells에 대한 CCK-8 assay와 LDH assay를 수행해 ACELNs의 세포 증식과 독성 억제 효과를 검증했다. ACELNs는 각 세포에 10∼200µg/mL 이하에서 농도의존적으로 처리했다. 세포 증식율은 HaCaT cells과 HDF cells에서 시료를 처리함에 따라 농도의존적으로 증가했다(그림3A, B).
HaCaT cells에서 대조군에 비해 약 29% 향상된 세포 증식율을 보였으며 HDF cells에서 대조군에 비해 약 25% 향상된 세포 증식율을 보였다. 세포에 대한 독성은 HaCaT cells과 HDF cells에서 시료를 처리함에 따라 농도의존적으로 유의하게 감소시켰다(그림3C, D).
위의 실험 결과를 통해 ACELNs가 피부 유래 세포인 HDF cells과 HaCaT cells에 대한 세포 독성이 나타나지 않으며, 세포 증식을 유의하게 증가시키는 것으로 확인할 수 있었다.
그림3 Effect of ACELNs on the cell proliferation and inhibition of cytotoxicity. Cell proliferation of (A) HaCaT cells, and (B) HDF cells measured by the CCK-8 assay after treatment with different concentrations for 48 h. Inhibition of cytotoxicity of (A) HaCaT cells, and (B) HDF cells measured by LDH assay.
*** p < 0.001 versus a control group.
3-3. 각질세포 외막 형성능 평가
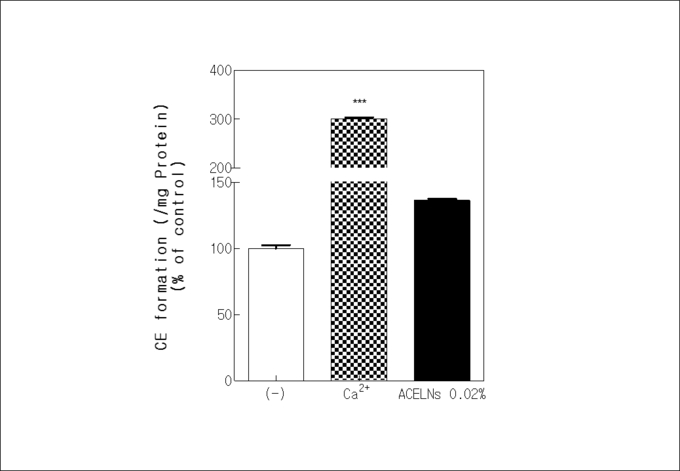
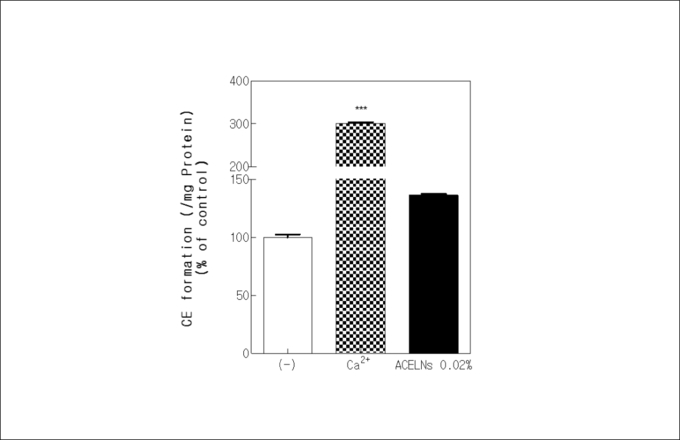
Keratinocyte는 분화의 정도에 따라 표피의 기저 층부터 각질층까지 분화가 이루어지게 된다. 각질 세포 외막(CE)와 각질세포 지질 외막(cornified lipid envelope, CLE)이 서로 공유결합으로 연결되어 있어서 피부 장벽 기능에 영향을 준다13). 따라서 각질세포 외막 형성능 평가를 통해 ACELNs의 각질세포 분화 유도효과를 검증했다.
양성대조군으로 각질 세포 분화의 조절인자인 칼슘 이온을 처리했다. 분화가 유도되지 않는 대조군에 비해 ACELNs를 처리한 HaCaT cells에서 약 36%의 각질세포 외막 형성능을 보였다(그림4). 이는 ACELNs 가 HaCaT cells의 분화를 촉진해 각질 형성하는데 도움을 줄 수 있음을 확인했다.
그림4 Cornified envelope (CE) formation increasing rate by ACELNs treatment in HaCaT cells.
*** p < 0.001 versus a control group.
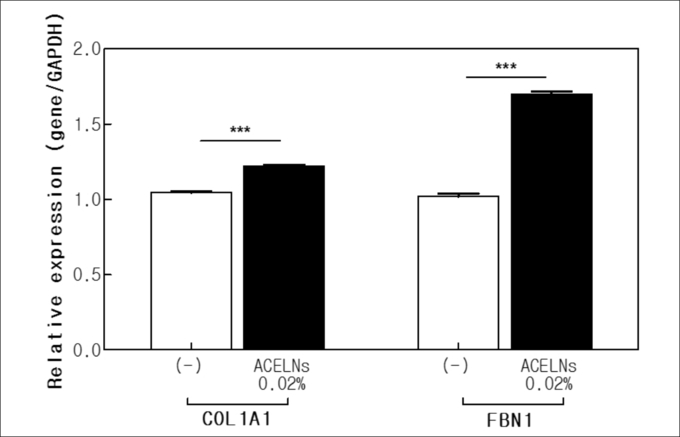
3-4. 유전자 발현에 따른 피부 항노화 효과
Collagen과 fibrillin은 피부 탄력과 노화에 관여하는 세포 외 기질 구성인자로 유전자 발현을 통해 피부 노화에 관한 효능을 평가했다. ACELNs의 처리에 따른 COL1A1과 FBN1유전자 발현은 세포독성이 없는 농도에서 qRT-PCR을 측정했다(그림5). COL1A1 발현은 ACELNs를 처리하지 않은 대조군에 비해 약 17% 증가했으며 FBN1발현은 대조군에 비해 약 67% 증가 했다. 위의 결과는 ACELNs가 COL1A1과 FBN1의 발현을 증가시켜 피부 탄력을 개선해 피부 항노화에 효과가 있는 것으로 사료된다.
그림5 The expression levels of Collagen Type 1 (COL1A1), and Fibrillin (FBN1) in HDF cells by qRT-PCR.
*** p < 0.001 versus a control group.
3-6. UVA에 조사된 피부 유래 세포의 단백질 생성량 분석
다른 기관과 달리 피부는 자외선과 직접적으로 접촉하기 때문에 피부 노화를 촉진시킨다14). 따라서 ACELNs 처리에 따라 자외선 조사에 의한 피부 노화에 미치는 효과를 확인하기 위해 UVA를 조사 시와 조사하지 않았을 때의 collagen 생성량을 분석했다.
두 가지 조건에서 대조군에 비해 ACELNs를 처리했을 시 collagen 함량이 증가됐다(그림6A). 특히 UVA를 조사했을 시 대조군(472.89ng/mL)에 비교해 ACELNs 처리 군(658.74ng/mL)이 약 39% 증가됐다. 또 UVA 조사된 HDF cells에서 ACELNs의 처리에 따라 세포 독성이 감소됐다(그림6B). 이는 ACELNs가 자외선이 조사된 HDF cells에서 collagen 생성에 영향을 주어 항노화 효과가 있음을 증명했다.
그림6 The effect of ACELNs on COLIA1 biosynthesis in UVA-irradiated HDF cells. (A) The concentrations of COLIA1 were measured via ELISA assay. (B) Protective effects of ACELNs on cytotoxicity of HDF cells against UVA-irradiated cell damage. *** p < 0.001 versus a control group.
4. 결론
PELNs는 나노 입자 크기, 낮은 독성, 생체적합성이 우수해 효율적으로 세포 간 상호작용을 통해 치료효과를 보일 수 있어 화장품, 건강기능식품, 의약품 등에 응용이 가능하다6). PELNs를 활용하기 위해서는 충분한 양을 생산할 수 있으며 일정한 품질을 지니고 있어야 한다. 최근 연구에 따르면, 식물 세포 배양 배지에서 exosome-like nanovesicles를 분리했고 이는 단백질, 2차 대사산물, 지질 성분들을 포함하고 있다고 보고했다15).
사과 열매는 다양한 생물학적 활성물질을 함유하고 있어 여러 산업분야에서 활용할 수 있는 소재이다. 다양한 활성물질이 함유하고 있음에도 불구하고 사과 열매 유래 exosome-like nanovesicles에 대한 피부 효능 연구는 보고되지 않았다.
본 연구에서는 사과 캘러스로 부터 ACELNs를 분리 했고 in vitro에서의 피부 장벽과 피부 노화 관련 효능을 확인했다. 인체 유래 진피 섬유아세포인 HDF cells과 각질형성세포인 HaCaT cells에 대한 세포 증식 평가에서 농도 의존적으로 세포 증식율이 향상됐고 세포 독성 평가에서 농도 의존적으로 세포 독성을 감소시켰다. 각질 세포 외막 형성능 평가를 통해 분화되지 않은 대조군보다 ACELNs를 처리한 실험군에서 향상된 각질세포 외막 형성능을 보였다. 이는 피부 표피의 분화를 유도함으로써 각질 형성에 도움을 줄 수 있음을 시사했다.
또 ACELNs를 처리했을 시 피부 탄력 인자인 COL1A1과 FBN1의 발현을 증가시킴으로써 피부에 탄력을 주고 피부 노화를 방지하는 효능이 있는 것을 확인했다. UVA가 조사된 HDF cells에서 collagen의 합성을 촉진시켜 collagen 생성량이 대조군에 비해 약 39% 증가됐다.
이와 같은 결과들을 통해 ACELNs는 피부장벽을 개선할 수 있으며 피부 노화 완화에 우수한 효능이 있는 것으로 판단됐다. 현재 ACELNs를 비롯해 다양한 PELNs의 효능에 관한 연구는 이루어지고 있다. 하지만 PELNs의 유전자 조절 mechanism과 PELNs의 biomarker 등 아직 증명되지 않은 부분이 존재하기 때문에 추가적인 연구가 지속되어야 한다.
문의처
(주)바이오솔루션
주소 : (18111) 서울시 노원구 공릉로 232 서울 테크노 파크 804호
TEL : 02-3446-8884
FAX : 02-3445-1380
E-mail : bcm@biosolutions.co.kr
홈페이지 : biosolutions.co.kr
Copyright ⓒ Since 2012 COS'IN. All Right Reserved.
#코스메틱저널코리아 #CJK #2021년9월호 #화장품연구개발마케팅전문저널 #기술정보 #최신연구동향 #바이오솔루션 #피부장벽개선 #피부노화방지효능 #사과캘러스유래 #엑소좀 #Phytotherasome™ Apple #사과유용성분 #항염증 #항균 #항암 #심혈관계개선 #생물학적특성관련 #사과열매유래캘러스 #nanovesicles분리정량적분석 #피부장벽 #피부노화개선 #한림대학교 #생명과학과 #분자면역학연구실(Korea)